Avda. Trinidad, Nº 61. Aulario Torre Profesor Agustín Arévalo. Planta 0.
C.P. 38071 San Cristóbal de La Laguna.
Tenerife.
FECHA: 30/10/20
Xavier Giménez/
Universitat de Barcelona/
Valga el título de la magnífica composición de Paco de Lucía, genio donde los haya, para ilustrar el contenido de este artículo, precisamente sobre el agua. No cabe otra conclusión, a tenor de la investigación reciente sobre el preciado líquido, en la que se pone de manifiesto una más de las casi ochenta propiedades exóticas atribuibles al agua.
En pocas palabras, lo que los resultados acaban de demostrar, fuera de toda duda, es que nuestra familiar e imprescindible substancia líquida vital, es en realidad una mezcla de dos líquidos simples. Tan ridículamente sencillo de decir, como complejo de entender.

Vayamos por partes. Primero, un experimento que podemos hacer en casa. Colocamos un botellín lleno de agua en el congelador, y esperamos suficiente tiempo como para congelar su contenido. Si un buen número de lectores realizaran el experimento, la mayoría obtendría el resultado esperado, es decir, agua congelada. Pero en algunos casos, en cambio, el agua continuaría líquida. Cierto. A los –18ºC de los congeladores domésticos, se puede obtener agua líquida. Se denomina agua subenfriada, y técnicamente se describe como un estado metaestable del agua. Este palabro complicado, metaestable, nos indica que dar un pequeño golpe, o añadir un granito de sal, o de hielo, al agua líquida subenfriada, provoca que se congele inmediatamente.

Experimentos un poco más sofisticados han permitido mantener este estado líquido, subenfriado, hasta –48.3ºC. Aunque exótica, el agua subenfriada está presente en la naturaleza. Muchas nubes, principalmente estratos y cúmulos, contienen una fracción importante de microgotas líquidas subenfriadas, a temperaturas entre –10 y –20ºC, por cierto más frías que el aire circundante. Tanto es así, que los aviones que cruzan estas nubes pueden experimentar una súbita congelación de su superficie alada, precisamente por provocar esa perturbación que lleva el agua a su estado natural a esas temperaturas, el hielo.
También, algunos animales pueden sobrevivir a temperaturas bajo cero, gracias a proteínas que se adhieren a la capa de hielo e impiden su crecimiento en el interior de su organismo. Algo caso parecido ocurre en muchas plantas, por acción de la lignina o la suberina.
No menos importante, el subenfriado se utiliza para preservar órganos humanos en trasplantes. Un hígado subenfriado, por ejemplo, se puede mantener hasta cuatro días sin daño alguno, cuatro veces más que las técnicas habituales de preservación.
En la segunda parte de nuestro experimento sobre el proceso de subenfriado, investiguemos que ocurre más allá de los –48.3ºC. A partir de esa temperatura, se produce lo que se denomina congelación homogénea, es decir, el paso al estado sólido sin intervención de “semillas” que nuclean el crecimiento del cristal… aunque eso no ocurre siempre. Si el enfriamiento es extraordinariamente rápido, del orden de un millón de grados por segundo, se obtiene un extraño sólido, el denominado hielo amorfo o vítreo, un sólido cuya estructura no muestra el orden típico de los sólidos comunes. Efectivamente, el nombre vítreo nos indica que el familiar vidrio es también un sólido amorfo. En estos casos, incluso la distinción entre sólido y líquido no está clara, puesto que el mismo vidrio sólido es capaz de fluir, aunque muy lentamente. Lo podemos comprobar en los ventanales de los edificios muy antiguos, que muestran un grosor mayor en la base que en altura, precisamente por la acción de la gravedad y la capacidad de fluir.
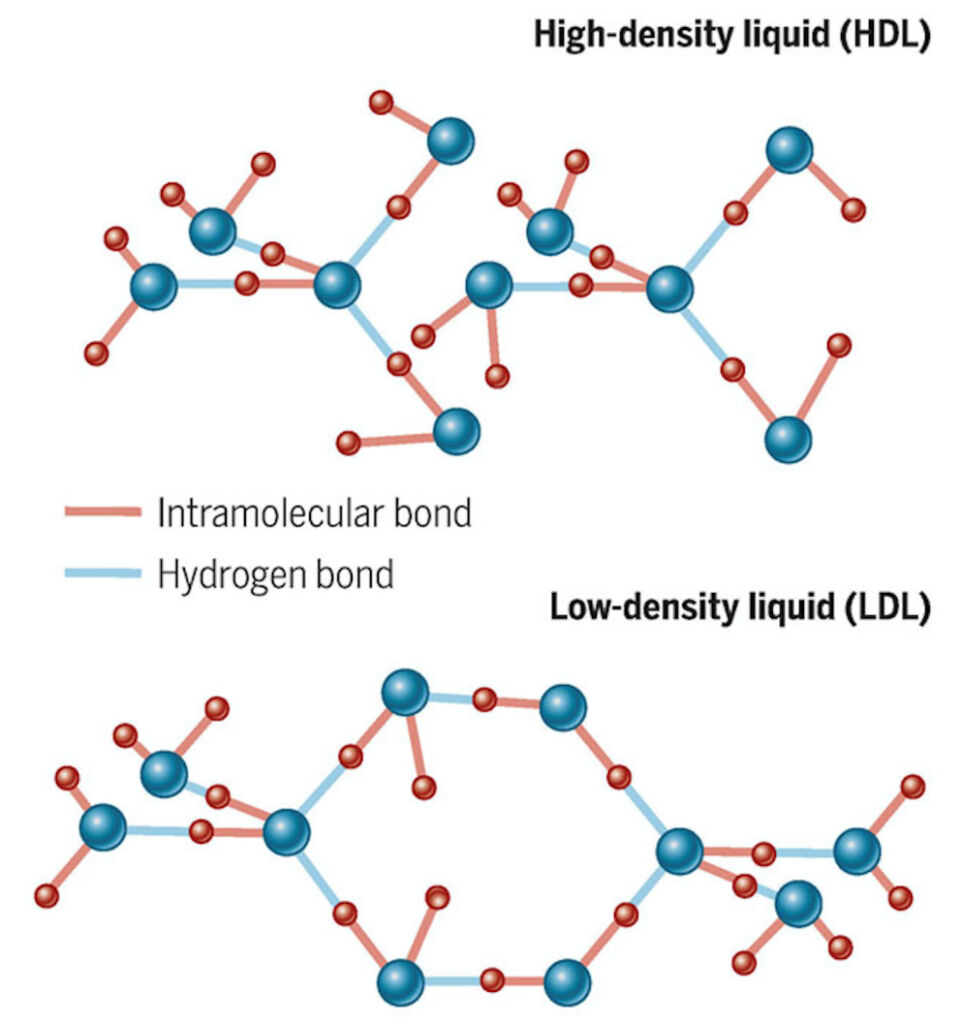
Formas de obtener este hielo amorfo incluyen también la deposición de pequeñas gotas sobre superficies metálicas muy frías, incluso por debajo de –150ºC. Los diferentes experimentos en esas raras condiciones metaestables revelan una riqueza de comportamientos totalmente inesperada. Por ejemplo, el hielo amorfo se obtiene en dos tipos, de densidades muy diferentes, que al calentar por encima de –137ºC primero, y –123ºC después, muestran transiciones al estado líquido subenfriado del que ya hablábamos… pero estados líquidos diferentes, según la densidad. En particular, el existe un hielo amorfo de baja densidad, parecido al hielo típico, que a su vez da lugar al agua líquida subenfriada de baja densidad. Es una estructura abierta de las moléculas de agua, enlazadas entre sí por los famosos puentes de hidrógeno, tal como muestra la parte inferior de la figura:
En la parte superior, se muestra la estructura del líquido de alta densidad, donde se aprecia que las moléculas de agua se disponen en una configuración más compacta.
El hecho relevante, y lo que parecen mostrar los experimentos más recientes, es que el agua líquida es una mezcla fluctuante entre los dos tipos de estructuras mostradas, de alta y baja densidad, reflejo de los estados vítreos sólidos a muy baja temperatura. El agua, por tanto, son dos líquidos, que además fluctúan entre sí, como “nadando entre dos aguas”.
A pesar de ser estados exóticos, en realidad tienen un impacto tecnológico nada despreciable. El estudio de proteínas y otras biomoléculas, a partir de la denominada crio-microscopía electrónica, refleja fielmente el estado real de su entorno biológico. Y ello ha sido posible pese a congelar estas biomoléculas. ¿El truco? Congelar el agua hasta obtener hielo amorfo, que no distorsiona la estructura como sí lo hacen las técnicas tradicionales mediante rayos X. Es un paso decisivo hacia el diseño de medicamentos mucho más eficientes.
Otro ejemplo más que la exploración del conocimiento nos guarda magníficas sorpresas, por supuesto insospechadas.